اسم التجربة: إنشاء منحنى قياسي باستخدام BSA بواسطة طريقة BCA
- kubratas1582
- 15 مايو 2025
- 4 دقيقة قراءة
الهدف:
مقدمة: يُعد تحديد تركيز البروتين المُستحصل عليه بطرق تنقية البروتين خطوةً مهمة. ولهذا الغرض، تُستخدم على نطاق واسع طريقة التحليل الطيفي الضوئي (BCA). تعتمد هذه الطريقة على اختزال أيونات Cu²⁺ إلى أيونات Cu⁺ نتيجة تفاعل البروتينات مع الروابط الببتيدية في بيئة قلوية.
في المرحلة الأولى، تُضاف كبريتات النحاس إلى محلول حمض البيسينكونينيك القلوي (BCA) لتكوين معقد بلون أخضر تفاحي. عند إضافة هذا المحلول إلى محلول يحتوي على بروتينات، تتفاعل أيونات النحاس (Cu+2) مع الروابط الببتيدية للبروتينات وتتحول إلى أيونات النحاس (Cu⁺). تعتمد كمية النحاس المختزل على تركيز البروتين ومدة الحضانة. ونتيجةً لتفاعل البروتينات مع أيونات النحاس (Cu+2)، يتشكل لون بنفسجي-أرجواني، ويُحصل على محلول بنفسجي بأقصى قيمة امتصاصية تبلغ 562 نانومتر. وتتناسب شدة (امتصاص) هذا اللون طرديًا مع كمية البروتين.
يُشبه هذا تفاعل البيوريت من حيث تفاعل الروابط الببتيدية وأيونات النحاس (Cu²⁺) في الظروف القاعدية. على الرغم من أن طريقة BCA تتبع آلية مشابهة لتفاعل البيوريت التقليدي، إلا أنها توفر حساسية ودقة أعلى بفضل المركب الملون المُكوّن من حمض البيسينكونيك مع أيونات Cu⁺. وهو اختبار سريع (30-24 ساعة) ودقة قياس عالية. ولا يتأثر بعوامل مثل المنظفات وبعض المذيبات العضوية (اليوريا وكلوريد الغوانيدينيوم).
مواد:
1) أ) كاشف BCA أ: كربونات الصوديوم (Na2CO3)، بيكربونات الصوديوم (NaHCO3)، حمض البيسينكونينيك، طرطرات الصوديوم (Na2C4H4O6)، هيدروكسيد الصوديوم (NaOH)
ب) كاشف BCA B: % كبريتات النحاس (كبريتات النحاس)
*يتم استخدام الكاشف A والكاشف B لمراقبة تغير اللون.
2) محلول بروتيني قياسي من مصل الذرة البقري (BSA) بتركيز 2 ملغ/مل
3) أنابيب إيبندورف
4) لوحة صغيرة من 96
5) الماصة الدقيقة ورؤوس الماصة
6) الحاضنة
4) قارئ الصفائح الدقيقة
5) بي بي إس
محلول PBS (محلول ملحي فوسفاتي منظم):
8 جرام من كلوريد الصوديوم (NaCl)،
0.2 جرام من كلوريد البوتاسيوم (KCl)،
0.2 غرام KH2PO4 (فوسفات ثنائي هيدروجين البوتاسيوم)
1.15 جرام Na2HPO4 (فوسفات الهيدروجين ثنائي الصوديوم)
يذاب في 1 لتر من الماء المقطر ويضبط الرقم الهيدروجيني إلى 7.2.
ألبومين مصل البقر (BSA):
طُرق
1) مارك 6 أنابيب إيبندورف من 1 إلى 6.
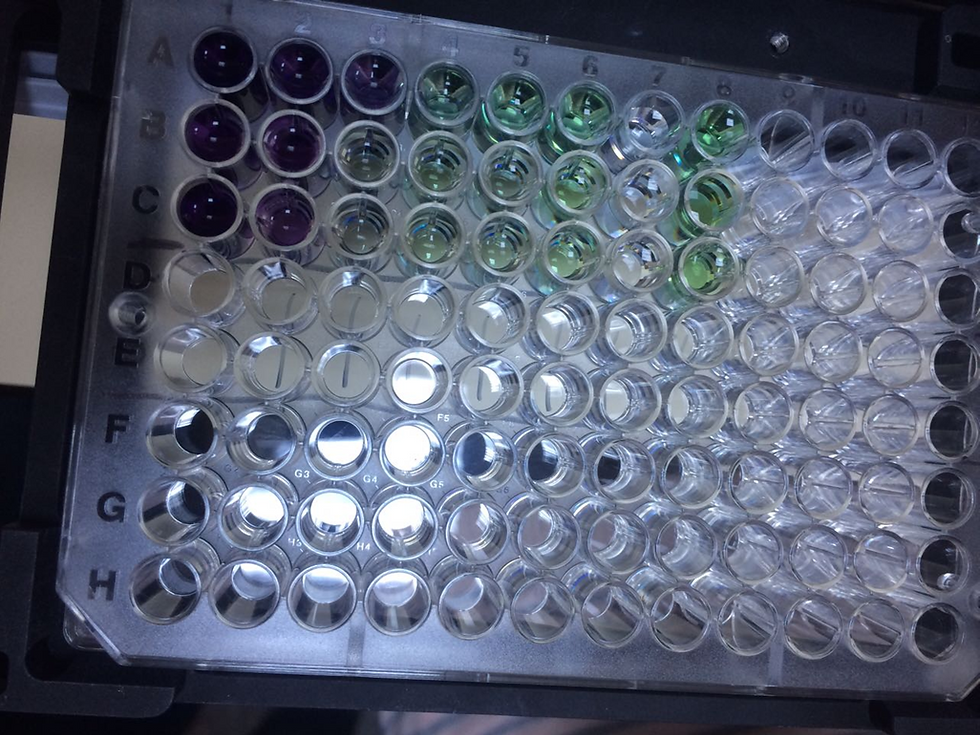
٢) حضّر ستة محاليل قياسية باستخدام PBS بتخفيفات ١/١، ١/٢، ١/٤، ١/٨، ١/١٦، ١/٣٢ من محلول BSA القياسي بتركيز ٢ ملغ/مل المرفق مع طقم BCA. أجرينا التخفيف باستخدام محلول PBS.

3. سيتم وضع المعايير المحضرة بمقدار 25 ميكرولترًا في آبار اللوحة الدقيقة
استخدم الماصة حسب الشكل (استخدم 3 آبار لكل معيار).
4) لأغراض التحكم، أضف PBS فقط إلى الآبار الموجودة في الصف 7.
٥) حضّر نسبة ٥٠:١ من راجنت أ إلى راجنت ب، أي ما مجموعه ٥ مل، وأضف ٢٠٠ ميكرولتر إلى كل بئر مع العينات. لأغراض الضبط، أضف هذا الخليط فقط إلى الآبار في الصف الثامن.

6.) قم بتغطية اللوحة الدقيقة المحضرة بالبارافيلم واحتضانها عند 37 درجة مئوية. (30 دقيقة).
7.) قم بتشغيل قارئ اللوحة الدقيقة وضبطه على البرنامج المطلوب.
8) قم بإحضار اللوحة الدقيقة التي تم إخراجها من الحاضنة إلى درجة حرارة الغرفة. (لاحظ تغير اللون).
9) امسح اللوحة الدقيقة عند 562 نانومتر.

مع إكسل


هيكل الجدول:
الأعمدة 1-6:
أ، ب، ج:
AVG.:
وفقًا لهذه القيم، تحتوي العينة 1 على أعلى كمية من البروتين، بينما تحتوي العينة 6 على أقل كمية.


(رسم بياني تم إنشاؤه بنسب البروتين في جهاز قياس الطيف الضوئي (خطي))
📊 تعليق الرسم البياني:
على المحور X:
على المحور Y:
🔹 المعادلة الخطية:
ص=2.7511س+0.0038
هذه المعادلة هي معادلة الانحدار الخطي للمنحنى القياسي.
Y: الامتصاص
X: تركيز البروتين
وتخبرنا المعادلة أن:
الامتصاص = 2.7511 × التركيز + 0.0038
🔹 قيمة R²:
R2=0.991
يوضح هذا مدى ملاءمة خط الانحدار للبيانات.
كلما اقتربت من 1، كلما كان الملاءمة أفضل.
0.991
دعوى:
كما يمكن رؤيته:
يتم فرز القيم بترتيب تنازلي من اليسار إلى اليمين.
من المرجح أن يشير هذا إلى أن التركيز قد انخفض أو تم تخفيف العينات.
القياسات قريبة جدًا →
إن حقيقة أن التكرارات التجريبية (أ، ب، ج) قريبة من بعضها البعض تظهر أن التجربة موثوقة.
قيمة R² للمنحنى القياسي هي 0.991، مما يشير إلى وجود علاقة خطية. (تكشف هذه القيمة عن أن البيانات تُظهر اتفاقًا كبيرًا مع النموذج الخطي. كلما اقتربت من القيمة 1، كان ذلك أفضل.)
انخفضت القيم بشكل حاد، وهو أمر جيد، إذ يشير إلى إجراء تخفيف.
مع ذلك، على الرغم من وجود فروق جوهرية بين التركيزات الثلاثة الأولى، إلا أن هذه الفروقات تتناقص عند التركيزات المنخفضة مثل 4،5،6. وعندما تكون القيم متقاربة جدًا، فإن غياب فرق كبير بين القيم اللاحقة يشير إلى أن نسبة التخفيف غير صحيحة.
الأسباب المحتملة:
١. قد يكون هذا بسبب التقطير. ربما تناثر البروتين.
2. عند التركيزات المنخفضة، قد تنخفض دقة القياس.
3. قد يكون من الضروري القيام بمزيد من التكرارات أو مراعاة حساسية الجهاز.
4. ومع ذلك، إذا كانت هذه الاختلافات لا تزال تتناسب مع المنحنى الخطي ولم يكن الانحراف كبيرا، فإنها لا تعتبر مشكلة خطيرة.
إذا لزم الأمر، قد يوصى باستخدام أنابيب أكثر دقة وتكرارات إضافية في هذه المنطقة.
وبشكل عام كانت النتائج كما هو متوقع وناجحة.
حاشية: إذا كانت الامتصاصيات في التركيزات المنخفضة والعالية قريبة جدًا من بعضها البعض، فهذا يعني أن:
إما أن تركيزات المحلول القياسي لم يتم تحضيرها بشكل صحيح (جميع الأنابيب تحتوي على محتوى بروتين مماثل)،
أو لم يتم إجراء قياسات جهاز الطيف بشكل صحيح (على سبيل المثال، وصل الجهاز إلى التشبع أو أعطى خطأ).
إذا لم يكن هناك فرق بين العينات ذات التركيز العالي بشكل خاص والتركيزات المنخفضة،
في هذه الحالة، لن يظهر المنحنى القياسي، أو سيكون R² منخفضًا للغاية - أي أن الخطية ستضيع.
وبالإضافة إلى ذلك، فإن هذا سيكون خطأً فادحاً من حيث دقة وموثوقية طريقة BCA.
نتيجة:
في هذه التجربة، تم تحديد كميات البروتين في عينات مختلفة بنجاح باستخدام طريقة BCA. وتبين أن المنحنى المعياري موثوق، وتم حساب تركيزات العينات بدقة. وعلى الرغم من وجود فروق محدودة بين التركيزات المنخفضة، إلا أن دقة التجربة مُرضية. باستخدام هذا المنحنى المعياري، يُمكن حساب كمية البروتين في العينات المجهولة بأمان. وتتميز طريقة BCA بحساسيتها وموثوقيتها، خاصةً لعينات البروتين منخفضة التركيز.
فهرس:
تعليقات