Deney ADI: BCA Yöntemi ile BSA Kullanarak Standart Eğri Oluşturulması
- kubratas1582
- 15 May 2025
- 4 dakikada okunur
Amaç: BCA yöntemiyle, protein standartları oluşturarak bilinmeyen protein örneklerinin konsantrasyonlarını karşılaştırma yaparak tayin etmek.
Giriş: Protein saflaştırma metotlarında elde edilen proteinin konsantrasyonunun belirlenmesi önemli bir aşamadır. Bunun için ise yaygın olarak spektrofotometrik bir analiz yöntemi olan BCA yöntemi kullanılmaktadır. Bu yöntem, alkali ortamda Cu²⁺ iyonlarının proteinlerin peptit bağları ile etkileşimi sonucu Cu⁺ iyonlarına indirgenmesine dayanır.
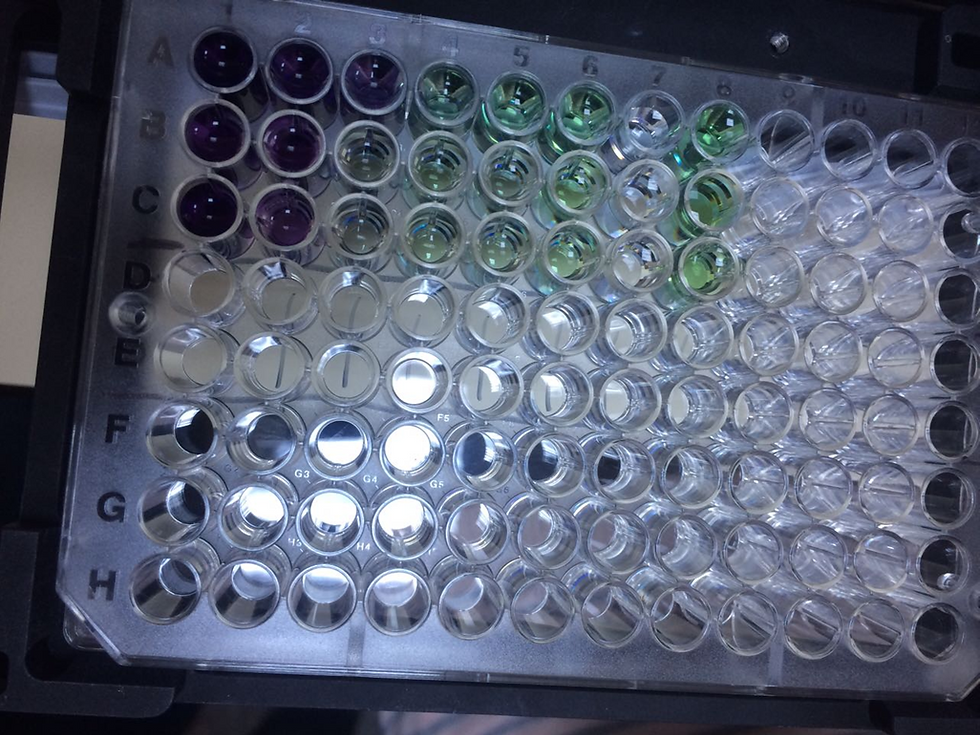
İlk aşamada alkalin BCA (Bicinchoninic Asit) Çözeltisine eklenen bakır sülfat, elma-yeşil renkli bir kompleks oluşturur. Bu çözelti ise protein içeren bir çözeltiye ilave edildiğinde Cu+2 iyonları proteinlerin peptit bağları ile etkileşime geçerek Cu⁺ iyonlarına dönüşür. İndirgenmiş bakır miktarı, protein konsantrasyonu ve inkübasyon süresine bağlıdır. Sonuçta proteinler ile bakır(Cu+2) iyonlarının tepkimesi sonucu mor-lila bir renk oluşur ve maksimum absorbans ölçüm değeri 562 nm olan mor renkli bir çözelti elde edilmiş olur. Bu rengin yoğunluğu (absorbansı), protein miktarıyla doğru orantılıdır.
Peptit bağları ve bakır iyonlarının (Cu²⁺) bazik koşullar altında etkileşime girmesiyle biüret reaksiyonuyla benzerlik gösterir. BCA yöntemi, klasik biüret reaksiyonuna benzer bir mekanizma izlese de, bicinchoninic asidin Cu⁺ iyonları ile oluşturduğu renkli kompleks sayesinde daha yüksek hassasiyet ve doğruluk sağlar. Hızlı sonuçlanan (30 min.-24h.) ve ölçüm hassasiyeti yüksek bir testtir. Deterjan ve bazı organik çözücüler (üre ve guanidinyum klorür) gibi ajanlardan etkilenmez.
Materyaller :
1) a) BCA Reagent A: Sodyum karbonat (Na2 CO3), sodyum bikarbonat (NaHCO3), bicinchoninic asit, sodyum tartarat (Na2C4H4O6), sodyum hidroksit (NaOH)
b)BCA reagent B: % küprik sülfat (bakır sülfat)
*Reagent A ve Reagent B renk değişimini gözlemlemek için kullaılır.
2) BSA (Bovine Sıĝır Serum Albumin) protein standart çözeltisi 2 mg/ml
3) Eppendorf Tüpler
4) 96'lık mikroplaka
5) Mikro Pipet ve pipet uçları
6) inkubator
4) Mikroplaka okuyucusu
5)PBS
PBS (Phosphate Buffered Saline) solüsyonu: Test ve araştırma çalışmaları için alınan kan veya ilik örneklerinde, hücrelerin yıkanmasında kullanılan tampon çözeltidir.
8 gr NaCl (sodium klorür),
0,2 gr KCl (potasyum klorür),
0,2 gr KH2PO4 (potasyum dihidrojen fosfat)
1.15 g Na2HPO4 (disodium hidrojen fosfat)
1 litre distile suda çözdürülüp pH 7,2’ye ayarlandı.
BSA (Bovine Sığır Serum Albumini) : Sığır Albümini standart protein olarak Kullanılır. Ayrıca bu proteine Fraksiyon V de denir. BSA proteini 604 amino asitten oluşur. Proteinin N termal ucunda 1.8 amino asitten oluşan sinyal peptid dizisi Salgılanma Sırasında öncü proteinden aktarılır. Böylece 589 aminoasit içerir. Ayrica olgun BSA proteini olması için bu proteinden 4 aminoasit daha çıkarılır. Sonuç olarak 585 aminoasit içeren bir protein bulunur
METOD
1) 1'den 6’ya kadar 6 tane ependorf tüpünü işaretleyiniz.
2) BCA kitiyle beraber verilmiş 2mg/mL konsantrasyonuna sahip BSA standart çözeltisinden 1/1, 1/2, 1/4, 1/8, 1/16, 1/32 dilüsyonlarında PBS Kullanarak 6 adet standart çözelti hazırlayınız. PBS çözeltisiyle seyreltmemizi yaptık.

3. Hazırlanan standartları mikro plakanın kuyucuklarına 25 μl olacak
şekilde (her standart için 3 kuyucuk kullan) pipetleyiniz.
4). Kontrol amacıyla 7. sıradaki kuyucuklara sadece PBS ekleyiniz.
5.) 50:1 oranında Ragent A : Ragent B çözeltisini totalde 5 mL. olacak şekilde hazırlayınız ve örneklerin olduğu her bir kuyucuğa 200 μl ekleyiniz. Kontrol amacıyla 8. sıradaki kuyucuklara sadece bu karışımı ekleyin.

6.) Hazırlanan mikro plakayı parafilmle kapatarak 37°c de inkübe ediniz. (30 min.)
7.) Mikroplaka okuyucusunu açarak istenilen programa ayarlayınız.
8) İnkübatörden çıkarılan mikroplakayı oda sıcaklığına getiriniz. (Renk değişimini gözlemleyiniz).
9) Mikroplakayı 562 nanometrede okutunuz.

Exel ile :


Tablo yapısı:
1–6 numaralı sütunlar: Muhtemelen bilinmeyen örnekler (veya farklı konsantrasyonlar).
A, B, C: Aynı örneğin 3 tekrarı (triplicate ölçümler).
ORT.: Her numunenin ortalama absorbans değeri.
-> Bu değerlere göre, örnek 1 en yüksek protein miktarına sahip, örnek 6 ise en düşük.


(Spektrofotometredeki protein oranlarıyla oluşturulmuş bir grafik (Doğrusal))
📊 Grafik Yorumu:
X Ekseninde: Konsantrasyon (mg/mL)
Y Ekseninde: Absorbans (ölçülen renk yoğunluğu – genellikle 562 nm’de ölçülür)
🔹 Doğrusal Denklem:
y=2.7511x+0.0038
Bu denklem, standart eğrinin doğrusal regresyon denklemi.
y: absorbans
x: protein konsantrasyonu
Denklem bize şunu söylüyor:
Absorbans = 2.7511 × Konsantrasyon + 0.0038
🔹 R² Değeri:
R2=0.991
Bu, regresyon doğrusunun veriye ne kadar iyi uyduğunu gösterir.
1'e ne kadar yakınsa, o kadar iyi uyum vardır.
0.991, mükemmele oldukça yakın bir değer → doğru, veriye çok iyi oturmuş.
Tartışma:
Görüldüğü üzere:
Değerler soldan sağa azalan şekilde sıralanmış.
Bu durum, büyük ihtimalle konsantrasyonun azaldığını veya numunelerin seyreltildiğini gösteriyor.
Ölçümler birbirine oldukça yakın → tekrarlanabilirlik iyi, güvenilir bir deney yapılmış.
Deneysel tekrarların(A,B,C) birbirine yakın olması, deneyin güvenilir olduğunu göstermektedir.
Standart eğrinin R² değeri 0.991 olup, doğrusal bir ilişki kurulduğunu göstermektedir. (Bu değer, verilerin doğrusal modele yüksek uyum gösterdiğini ortaya koymaktadır. 1 değerine ne kadar yakınsa o kadar iyi )
Değerler düşüş yaşamış, bu iyi bir şeydir. Çünkü bir seyreltmenin gerçekleştirildiğini gösterir.
Fakat ilk üç konsantrasyon arasında belirgin farklar varken 4,5,6 gibi düşük konsantrasyonlarda farklar azalıyor. Değerler bu kadar yakınken sonraki değerler arısnda yüksek bir farkın olmaması seyreltme oranının doğru olmadığını gösterir.
Olası sebepler:
1. Bu belki pipetaj kaynaklı olabilir. Protein sıçramış olabilir.
2. Düşük konsantrasyonlarda ölçüm hassasiyeti azalabilir.
3. Daha fazla tekrar yapmak veya cihaz hassasiyetini göz önünde bulundurmak gerekebilir.
4. Ancak bu farklar hala doğrusal eğriye uyuyorsa ve sapma büyük değilse ciddi bir sorun sayılmaz.
Gerekirse bu bölgede daha hassas pipetleme ve ek tekrarlar önerilebilir.
Genel olarak sonuçlar beklendiği gibi ve başarılıdır.
Dipnot: Eğer hem düşük hem yüksek konsantrasyonlarda absorbanslar birbirine çok yakın çıksaydı, bu şu anlama gelirdi:
· Ya standart çözelti konsantrasyonları doğru hazırlanmadı (tüm tüpler benzer protein içeriğine sahip),
· Ya da spektrofotometre ölçümleri doğru yapılmadı (örneğin cihaz doygunluğa ulaştı veya hata verdi).
-> Özellikle yüksek konsantrasyondaki numunelerle düşükler arasında fark yoksa, reaksiyon tamamlanmamış olabilir veya reaktif miktarı yetersiz kalmış olabilir.
-> Bu durumda standart eğri çıkmaz ya da R² çok düşük olurdu — yani lineerlik kaybolurdu.
-> Ayrıca bu durum, BCA yönteminin doğruluk ve güvenilirliği açısından ciddi bir hata olurdu.
Sonuç:
Bu deneyde, BCA yöntemiyle çeşitli örneklerdeki protein miktarları başarılı şekilde tayin edilmiştir. Standart eğri güvenilir bulunmuş ve örneklerin konsantrasyonları doğru şekilde hesaplanmıştır. Düşük konsantrasyonlar arasındaki sınırlı farklara rağmen, deney doğruluğu tatmin edici düzeydedir. Bu standart eğriyle, bilinmeyen örneklerdeki protein miktarını güvenle hesaplayabilirsin. BCA yöntemi, özellikle düşük konsantrasyonlu protein örnekleri için hassas ve güvenilirdir.
Kaynakça:
Smith, P.K., Krohn, R.I., Hermanson, G.T., Mallia, A.K., Gartner, F.H., Provenzano, M.D., Fujimoto, E.K., Goeke, N.M., Olson, B.J., & Klenk, D.C. (1985). Measurement of protein using bicinchoninic acid. Analytical Biochemistry, 150(1), 76-85.


Yorumlar